【高压冷冻】 HPM Live µ:活细胞光电关联(CLEM)高压冷冻(HPF)的前沿技术
Xavier Heiligenstein1, Chie Kodera1, Yann Bret1, Frederic Eyraud1, Vincent Muczynski3,Jérôme Heiligenstein1, Martin Belle
机构:
CryoCapCell,勒克雷姆兰-比赛特尔,法国
伦敦大学学院-癌症研究所,伦敦,英国
CLEM新技术:HPM Live μ

摘要
光电关联显微技术(CLEM)是一种综合了多种技术和工作流程的科学方法。其中一项开创性的工作流程是:在进行活体观察后不久,通过高压冷冻(HPF)的方式将样本进行冷冻固定。尽管其具有非凡的潜力,但由于实际原因,它并未成为常规技术。我们重新设计了整个工具集,从样本载体(CryoCapsule)到高压冷冻机(HPM Live μ),以实现技术的标准化和普及化。在我们的论文中,我们介绍了样品从活体到高压冷冻电子显微镜的常规工作流程的所有技术发展。我们展示了能够实时追踪快速移动的内体,并在电子显微镜水平上以三维形式、高置信度将其检索出来的能力。

介绍
在过去的二十年里,光电关联显微技术(CLEM)对于解析不同尺度下的生物复杂性变得至关重要。这一工作流程的关键在于以接近天然状态固定样本,并尽量减少人为干扰,从而确保能够得出具有生物学意义的结论。电子显微镜(EM)凭借其丰富的经验和无与伦比的分辨率,如今正面临从化学固定转向通过玻璃化技术实现物理冷冻固定的转变挑战。
从 20 世纪 70 年代末开始,各种玻璃化方法相继出现,但迄今为止最主要的两种技术是“急速冷冻法”(特别适用于纯化的蛋白颗粒、病毒、单层细胞等厚度几微米或更薄的样品)和“高压冷冻法”(HPF),该方法适用于从单个细胞到厚度达 200 微米的组织切片等各种样本。特别是高压冷冻法,在历史上一直被认为复杂且不可靠。液氮以惊人的 2000 bar压力迅速释放,作用于样本的时间不到 25 毫秒,持续时间超过 150 毫秒,这就像一场爆炸,很容易使未加防护的生物材料散开。然而,作为通往复杂的电子显微镜实验流程(如 CEMOVIS、冷冻替代法、冷冻双束电镜Cryo-FIB减薄)的门户,高压冷冻法现在已成为准备具有最佳超微结构保存效果的样本(包括多尺度组织)不可或缺的技术。
迄今为止,大多数依赖于高压冷冻技术的 CLEM 方法都是先进行冷冻固定,然后对透明样本或树脂包埋样本(在树脂荧光法中)进行光学显微镜观察。因此,这两种方法都缺乏动态信息。
在高压冷冻(HPF)之前采用实时成像技术,能够较好地捕捉接近自然状态下的活体动态变化。然而,这需要一种特定的制备方法,以优化这两个步骤。生物样本需要放置在一个能够使样本在生理条件下进行实时成像,并同时提供对液氮高压流动的物理防护的装置中。此外,这两个步骤之间的时间间隔必须尽量缩短,以与生理时间尺度保持一致。
为应对这一挑战,我们在 2013 年率先开发了 CryoCapsule 这种创新容器。该容器由两个蓝宝石圆盘通过一个间隔环分隔而成,能够为培养细胞单层、放置小型模型生物或组织活检样本提供充足的空间。其一体化结构优化了从光学显微镜到高压冷冻机的转换时间。然而,这一转移过程仍是一项手动操作,取决于操作者的技能以实现可重复的结果,最佳表现时间为 15 秒。为了减少操作者的影响,我们引入了光显微镜和高压冷冻机的开创性结合,从而产生了 HPM Live µ。HPM Live µ、CryoCapsule 和光学显微镜的这种融合现在将可靠的转移时间缩短至 1.26 秒。从操作者启动玻璃化处理的指令到玻璃化过程的开始,精确的时间测量贯穿始终。这种自动化与先进的 CryoCapsule 技术的结合极大地提高了样本提取的成功率,几乎保证了 100%的成功率。因此,Live-CLEM-HPF 已从一个愿景转变为日常的现实。



结果
1、工作流程的可靠性
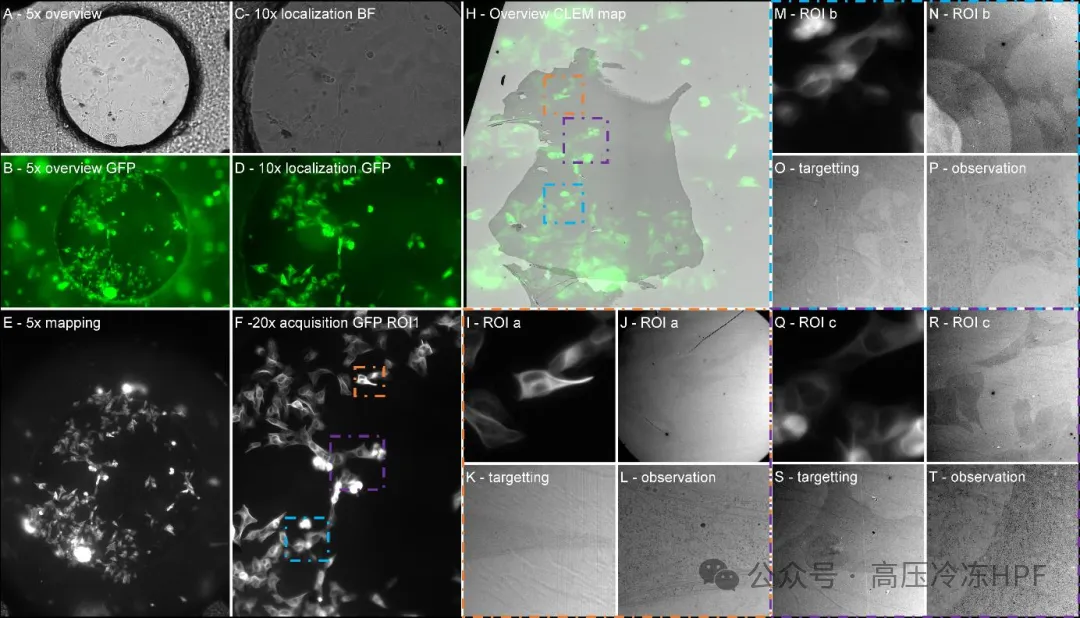
图解3:对多个细胞的完整实时 CLEM 跟踪。
A)在独立配置模式下,在显微镜上以低倍率观察CryoCapsule内的内容物。
B)表示表达 Tau-GFP 的 SY5Y-SH 细胞的总体视图。
C)一组感兴趣细胞的定位。
D)在亮场下观察这组感兴趣细胞。
E)带有集成显微镜的CryoCapsule的总体视图。
F)对感兴趣细胞的 20 倍实时成像,其中橙色(a)、蓝色(b)和紫色(c)的 ROI 被突出显示在 H 中。
H)用透射电子显微镜对第一部分进行的覆盖,与 5 倍映射进行叠加。
I)在 T 中突出显示橙色(a)、蓝色(b)和紫色(c)的 ROI。
J)I 中感兴趣的细胞(I)的定位,
K)目标定位,
L)观察到的 ROI(L)。
所有 3 个 ROI(a、b、c)以类似的方式展示,以说明我们能够在一个CryoCapsule中检索所有细胞的能力。
2、动态生物结构的应用:全CLEM工作流的高时空分辨率。
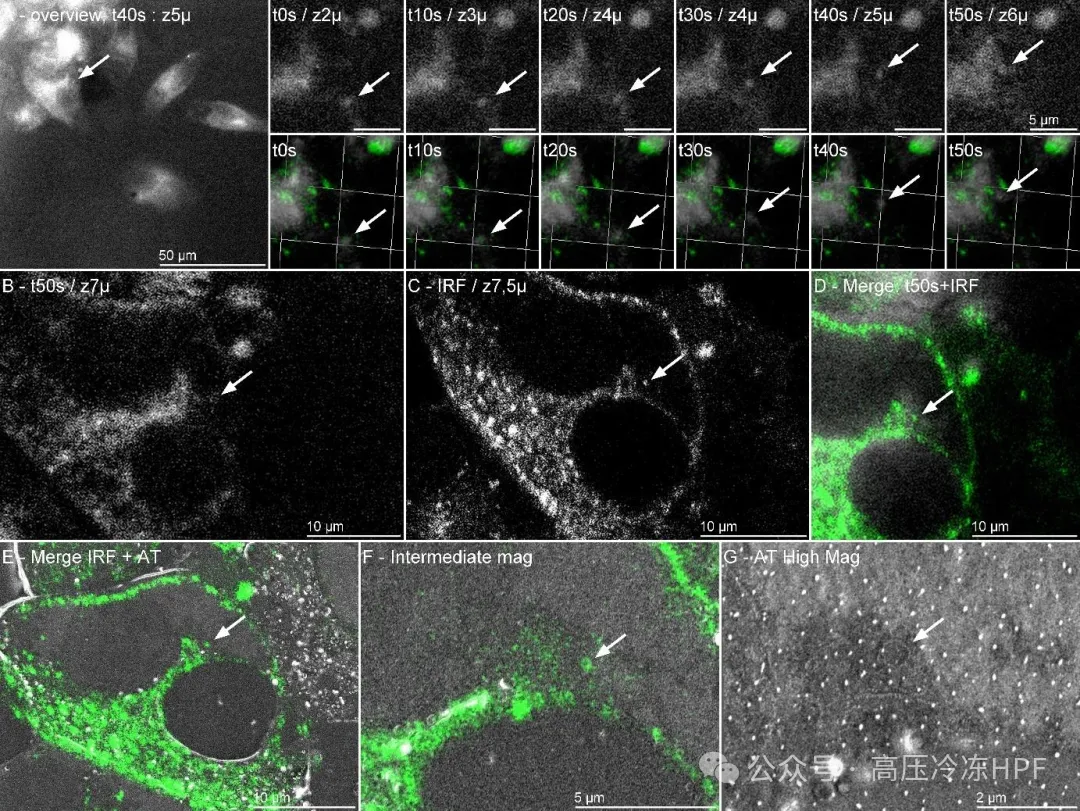
图解4:动态囊泡体的完整实时 CLEM 跟踪。
A)在 50 倍放大下,视野中可见多个细胞。其中有一个细胞的囊泡体是可追踪的,在整个成像过程中都能看到其移动情况。我们看到它在 60 秒的成像时间内,沿 X、Y 方向移动了约 5 微米,在 Z 方向上移动了 4 微米,间隔时间为 10 秒。将实时数据与共聚焦堆栈进行对齐,我们观察到荧光信号朝着作为定位标志的孤立荧光信号移动,以在阵列断层扫描堆栈中寻找囊泡体。箭头指向囊泡体。
B)冷冻固定前的最后一张图像。
C)共聚焦堆栈中的孤立切片。
D)实时数据的最后帧与共聚焦堆栈对齐,以识别孤立的囊泡体,并进行实时跟踪。
E)阵列断层扫描 3D 堆栈与共聚焦堆栈对齐。
F)在中间放大倍数下,我们定位了囊泡体。
G)在更高放大倍数下,囊泡体在预期的 X-Y 坐标处被找回,但在 Z 方向上偏移了 5 个切片,这表明 Z 方向上的对齐差异为 500 纳米。
总之,这表明了我们所建立的工作流程的全面性,包括样本培养、样本活体成像、冷冻固定以及高分辨率的后固定定位,最终通过电子显微镜(EM)能够清晰地呈现所关注的独特结构。
这一完整的流程,从实时成像到三维电子显微镜成像,是通过三种核心技术的结合得以实现的:CryoCapsule、HPM Live μ光电关联高压冷冻系统和 R221树脂,它们填补了所有成像步骤之间的样品制备环节的空白。

讨论及持续创新方向
设备和工作流程

设备
HPM Live µ 是Baltec公司历史悠久的 HPM010 系列的最新成果。它采用了专利的加压技术(已提交专利申请 PCT/EP2019071787)以及创新的图形用户界面(GUI)。该设备专为在传统载体(3 毫米和 6 毫米的膜载体、帽状载体、管状载体以及CryoCapsule)上进行常规的 HPF 实验而设计,并能与光学显微镜实现无缝集成。这种集成式设置将显微镜置于负责将样本转移到 HPF 装置的自动进样臂下方。
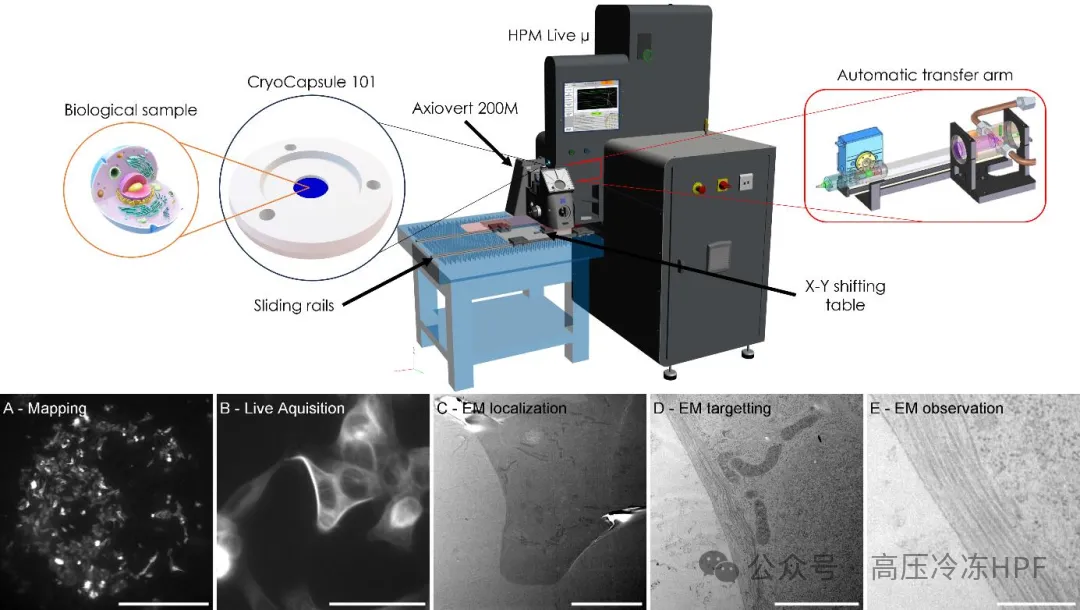
图解5:工作流程。
样本在 CryoCapsule 101 中培养,并通过自动进样臂顶端直接置于显微镜镜头上方。触发后,样本在 HPF 装置中进行玻璃化处理,耗时 1.26 秒。
A)在 CryoCapsule 中实时映射样本。
B)50 倍的实时成像。
C)在低倍显微镜下进行定位。
D)对感兴趣结构的定位。
E)对感兴趣结构的观察。

图解6:各种显微镜/高分辨率成像仪配置。
A) 将显微镜与高分辨率成像仪分离,使其独立使用。高分辨率成像仪也可以在没有显微镜的情况下使用。
B )将显微镜集成到高分辨率成像仪中。
C) 实时成像。
D) 在 5 倍低放大倍数下观察以定位感兴趣的细胞。
E) 在 20 倍放大倍数下成像。
F )在 1.26 秒内自动转移进行冷冻固定。
G )将显微镜与高分辨率台集成。
H )在低放大倍数下进行定位,并将感兴趣的细胞置于视野中心。
I )在 50 倍高放大倍数下进行实时成像。
J )将样品台手动推入高分辨率成像仪中进行实时观察。
K )在转移(J)后触发高分辨率成像仪,以在 1.26 秒内启动冷冻固定过程。

CryoCapsule的改进设计
为了进一步优化 CryoCapsule 的设计,我们进行了多项关键改进。腔体直径从 2 毫米减小至 1 毫米,这在两个方面有所提升:
1. 更窄的样本区域更便于在电子显微镜中进行关联,从而减少了对碳质标记物的需求。
2. 还将 100 微米厚度的硬化圆盘最大弯曲度进一步降低至 23 纳米。同时,CryoCapsule的深度从 50 微米增加到 100 微米,从而使其适用范围得以扩大,能够容纳各种样本,如活检样本、器官组织和小型模型生物。
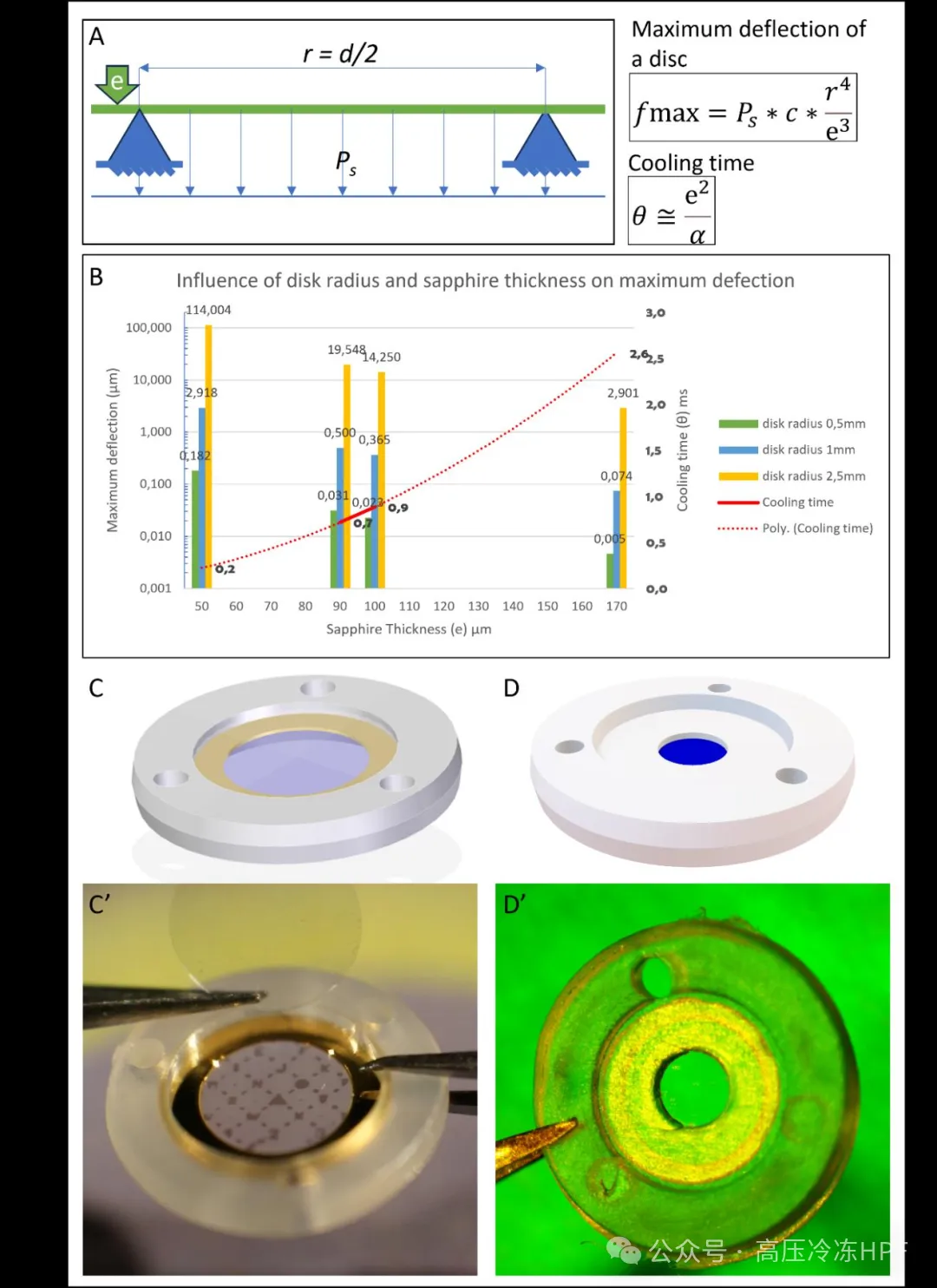
图解7:CryoCapsule 几何形状优化。
A)示意图展示了由间隔环(蓝色金字塔)支撑的蓝宝石盘以及所施加的压差(Ps)。蓝宝石的厚度标注为“e”,半径标注为“r”(即直径“d”的一半)。公式 1:由环支撑的圆盘最大变形的简化公式。公式 2:板的冷却时间的简化公式。
C)第一台CryoCapsule的示意图。
C')第一台CryoCapsule的图片。蓝宝石厚度为 50 μm,间隔环直径为 2 毫米,导致变形量接近 3 μm。
D)CryoCapsule 101 的示意图。
D')CryoCapsule 101 的图片。间隔环直径减小到 1 mm,蓝宝石厚度增加到 100 μm,结果变形量仅为 23 nm。

工作流程(参考)
1、在CryoCapsule内培养细胞或装载样品;
2、光镜(LM)观察:实时进行活细胞荧光成像;
3、高压冷冻(HPF):HPM Live μ 与倒置共聚焦显微镜耦合,实现光电关联高压冷冻;在 1.26 秒内完成高压冷冻固定过程。
4、冷冻替代(FS);
5、冷冻超薄切片机进行超薄切片;
6、透射电子显微镜成像(TEM);
7、单独样本数据表:样品管理软件:F°Low。
友情提示
https://doi.org/10.1101/2024.10.21.619370;

