【高压冷冻】 使用高压冷冻仪 HPM Live µ对多种类型样本进行高压冷冻玻璃化处理
Chie Kodera, Yann Bret, Frederic Eyraud,Jérôme Heiligenstein,Martin Belle, Xavier Heiligenstein
机构:
CryoCapCell,勒克雷姆兰-比赛特尔,法国
关键词:
玻璃化、高压冷冻(HPF)、电子显微镜(EM)、透射电子显微镜(TEM)、冷冻替代(FS)、树脂包埋
CLEM新技术:HPM Live μ

摘要
本研究探讨了高压冷冻(HPF)作为一种电子显微镜(EM)分析样本制备技术,在多种生物样本中的有效性与可靠性。采用基于BalTec公司经典液压装置HPM010的高压冷冻仪 HPM Live µ技术,我们验证了工业设备能够达到玻璃化所需的临界参数,从而确保其技术可靠性。通过直接测量高压冷冻室内的物理参数,进一步确认了设备运行的稳定性,有助于提升该技术在实际应用中的可信度。针对不同类型的样本,我们制定了详尽的处理方案,充分考虑了各类样本的特性,并将最终的样本分析结果与高压冷冻曲线进行关联,以实现实验方案的优化。实验涵盖了经高压冷冻处理的人类细胞团块、细胞单层、小鼠脑和肝活检组织、秀丽隐杆线虫、斑马鱼以及拟南芥根和幼苗,并通过电子显微镜对其超微结构进行了系统分析。结果显示,各类样本的超微结构保存良好,冰晶形成极少。诸如植物叶片玻璃化等技术难题也得到了有效解决,进一步体现了方法适应性的重要性。总体而言,本研究证实了HPM Live µ技术在生物样本超微结构保存方面的稳健性与通用性,为广泛应用于各类生物学研究中的电子显微镜分析提供了重要的技术支持与实践参考。

介绍
高压冷冻(HPF)实现的玻璃化是固定生物样本的一项关键技术,能够有效支持电子显微镜(EM)对其超微结构的分析。通过在高压条件下快速冷冻样本,HPF利用水的相变特性,避免冰晶的形成,促使水转变为无定形冰——一种具有玻璃状特性的固态结构。实现理想玻璃化所需的临界条件包括施加2076 bar的压力,在此压力下水的凝固温度为-22°C,随后温度迅速降至-100°C以下,降温速率超过2000 K/秒。在这些参数条件下,水可进入亚稳态的无定形状态,其密度接近液态水,从而有效维持周围生物材料的原有结构完整性。
为实现上述极端物理条件,我们采用压力高达2100 bar的液氮流,并在短短10毫秒内将其施加于样品表面。为在该过程中有效保护脆弱的生物材料,样品被夹置于两个小型金属载片之间,这些载片通常由铝或镀金铜制成。此类金属材料不仅能够将压力均匀传递至含水样品,还可凭借其优异的导热性能加速热量散除,从而提升玻璃化效率。
完成玻璃化处理后,样品可进一步采用电子显微镜技术进行分析,主要包括冷冻替代(FS)结合树脂包埋电子显微镜技术,以及冷冻电子显微镜(cryo-EM)技术。这些高分辨率成像方法能够清晰呈现样品的超微结构特征,对于深入理解生物分子及其复合物的功能与行为具有重要意义。
与传统的化学固定法及室温(RT)脱水法相比,高压冷冻-冷冻替代(HPF/FS)技术具有多项显著优势。具体可查看【HAL open science】I 采用高压冷冻/冷冻替代技术(HPF/FS)对 CADASIL病早期白质变化的特征研究以及【高压冷冻】 HPM Live µ:活细胞光电关联(CLEM)高压冷冻(HPF)的前沿技术。
本研究中所有生物样本均采用本团队新研发的高压冷冻仪HPM Live µ,在预设参数条件下完成玻璃化处理。实验过程中使用标准铝制载样载体,具体规格参数详见表1。为最大程度降低培养基成分对玻璃化效果的潜在影响,实验中添加了特定冷冻保护剂,具体种类及浓度详见表1。冷冻替代过程采用标准混合试剂进行处理,使用EPON树脂对样本进行包埋。最终,对厚度为70 nm的未染色超薄切片进行透射电子显微镜(TEM)成像分析。
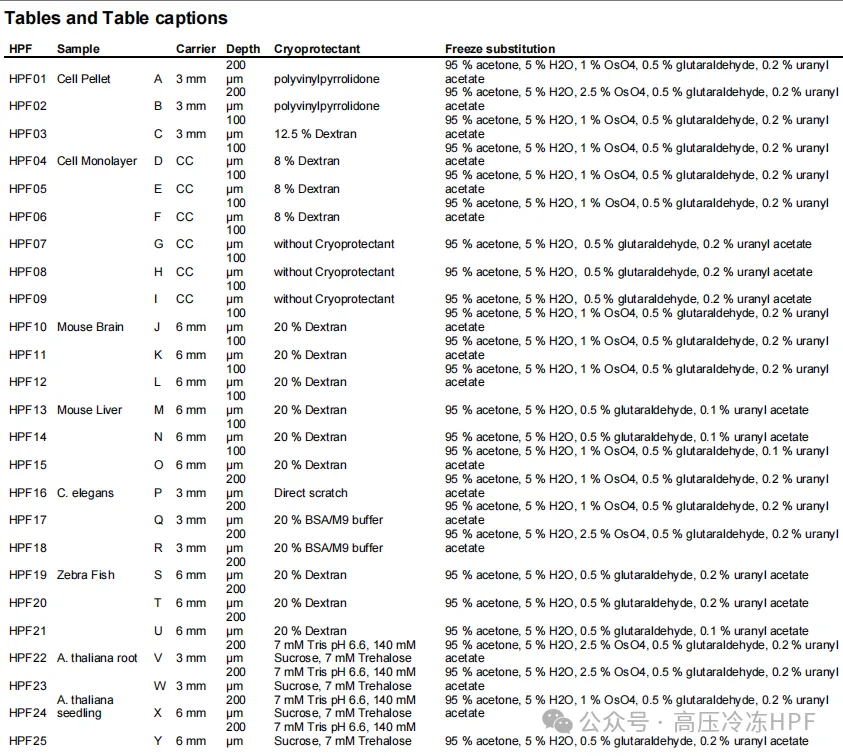
表1 高压冷冻条件
(25次独立实验的高压冷冻和冷冻替代参数条件)


材料和方法
1、高压冷冻(HPF)前的样品制备
1.1 单层细胞培养成细胞团
神经⺟细胞瘤细胞(SHSY-5Y型)在完全培养基(1×DMEM+GlutaMAX、20%胎⽜⾎清、G418)中培养⾄37℃、融合度达70%。⽤胰蛋⽩酶处理,⽤完全培养基重悬,离⼼沉淀细胞。将细胞沉淀重悬于冷冻保护剂(表1)中,然后⽤移液管移⼊A载体(3毫⽶)的100微⽶或200微⽶深的腔内(表1)。⽤B载体的平⾯侧封闭A载体,形成100微⽶或200微⽶深的腔,然后装⼊⾼压脉冲钳进⾏玻璃化冷冻。
1.2 单层细胞培养在Cryocapsule中
神经⺟细胞瘤细胞(SHSY-5Y型)在含1×DMEM+GlutaMAX、20%胎⽜⾎清和G418的完全培养基中培养,培养温度为37摄⽒度,直⾄细胞融合度达到40%,然后将其转移⾄CryoCapsule中。在玻璃化冷冻当天,使⽤蓝宝⽯盖⽚封闭CryoCapsule,并将其装⼊专⽤的CryoCapsule夹具中。参与光电关联显微技术(CLEM)项⽬的细胞在未添加冷冻保护剂的情况下,以5倍或20倍放⼤倍数进⾏成像(图4)。未参与CLEM项⽬的细胞则先暴露于8%的右旋糖酐中,然后按照先前描述的⽅法进⾏装载并进⾏玻璃化冷冻。
1.3 小鼠活检(脑和肝)
在活检前,⼩⿏被深度⿇醉,并通过⼼内灌注4%多聚甲醛(在150mM磷酸盐缓冲液中)进⾏前固定,以确保组织得到恰当的固定。前固定具有诸多优势:它能减缓样本降解,并增强组织硬度,从⽽便于后续使⽤振荡⼑进⾏切⽚。从活检到切⽚,组织或器官均保存在4°C的环境中。从切⽚到玻璃化冷冻的所有操作均在室温下进⾏。
随后⽤预先⽤冷冻保护剂溶液湿润过的B载体的平⾯侧将样本封装起来,以尽量减少⽓泡的封装。然后将组装件装⼊HPM夹具中进⾏玻璃化处理。有关视频可在我们的⽹站https://www.cryocapcell.
com/tips-and-tricks-for-em上观看。
1.4 秀丽隐杆线⾍
秀丽隐杆线⾍可采用两种策略将样本浓缩⾄载体中,分别为直接刮取法和冷冻保护剂方法。这两种⽅法能够使秀丽隐杆线⾍样本在载体中⾼效聚集,便于在随机超薄切⽚后于电⼦显微镜下取样。
1.5 斑⻢⻥-斑⻢⻥属
⾸先将斑⻢⻥幼⻥置于含有3毫升渗透⽔并加⼊10滴0.4%三⼄酸⽢油酯的35毫⽶培养⽫中进⾏⿇醉,⿇醉2分钟后,⽤巴斯德吸管⼩⼼地将幼⻥从培养⽫中取出,放置于A型载体(参⻅表1)上。⽤滤纸吸去载体上的多余⽔分,随后滴加⼀滴冷冻保护剂(20%葡聚糖在渗透⽔中),然后将载体密封。⽤预先⽤冷冻保护剂溶液浸湿的B载体的平⾯⼀侧进⾏玻璃化处理。
1.6 拟南芥(幼苗和根)
⽤镊⼦轻轻将幼苗从培养板上取出,⼩⼼放置于⼲净的载玻⽚上。为防⽌⼲燥,向植物上滴加⼏滴冷冻保护剂溶液(7毫摩尔/升Tris,pH值6.6,140毫摩尔/升蔗糖,7毫摩尔/升海藻糖)覆盖幼苗。
随后,将幼苗或⽤锋利的⾁剃⼑⽚切下的根尖转移到A载体(参⻅表1)中。再向载体中加⼊⼀滴冷冻保护剂,以确保样品得到恰当保护。然后⽤预先⽤冷冻保护剂湿润过的B载体的平侧将A载体密封,并进⾏玻璃化处理。
2.高压冷冻
在完成上述准备⼯作后,每个样本均使⽤我们的HPM Live µ高压冷冻仪(CryoCapCell,法国巴黎)进⾏玻璃化处理。在⾼压液氮流开始之前,对样本J、K、L进⾏了75毫秒的⼄醇预注⼊,⽽对其他样本则进⾏了150毫秒的预注⼊。这种预注⼊旨在延迟冷却,直⾄系统达到所需压⼒。在整个过程中,通过置于样本上⽅和下⽅的传感器直接测量⾼压室内的温度和压⼒。值得注意的是,本⽂中所呈现的数据均为原始数据,未经过任何处理或计算。这些未经处理的数据旨在说明我们的设备具有良好的重复性,并且能够精确地描绘出每个样本在⽔相图中的轨迹。
通过在所有样本中系统地应⽤相同的HPF参数,我们保持了⼀致性和标准化,从⽽将实验⽅案中的变异性降⾄最低。这种⽅法确保了整个实验组的结果具有稳健性和可重复性。
3.冷冻替代
4.超薄切片
5.透射电子显微镜成像

结论与展望
我们的研究证明了在⼴泛样本范围内能够保持⾼质量的超微结构,满⾜了⼤多数机构的要求。这⾥提出的样本制备参数很可能适⽤于所有⾼压冷冻设备。通过确保样本在⽔相图中经历适当的转变过程,研究⼈员可以将本论⽂作为指南来制定内部⾼压冷冻⽅案。
实验结果及图解

实验结果
25次独立实验的高压冷冻样本
⾼压冷冻(HPF)通常被认为是⼀种复杂的样品制备技术,其效果会受到样品类型、设备以及操作⼈员熟练程度等因素的影响⽽产⽣变化。然⽽,我们认为⾼压冷冻本质上是可靠的,只要经过⼏次试验就能掌握样品制备的关键要点。此外,HPM Live μ 在⾼压冷冻室内部直接测量物理值,这为评估设备性能提供了宝贵的⼯具。
在为新型样本类型建⽴操作流程时,将透射电⼦显微镜(TEM)分析与其对应的⾼压冷冻(HPF)曲线关联起来具有极⾼的价值。⼀条良好的⾼压冷冻曲线与⼀张质量⽋佳的图像并列,有助于指导样本制备过程的优化。
我们严格测试了由同⼀实验团队在同⼀设备上制备的多种样本。我们的样本选择涵盖了⼈类细胞培养物、⼩⿏活检样本(包括脑组织和肝组织)、秀丽隐杆线⾍、斑⻢⻥以及拟南芥(包括根和幼苗样本),这些样本代表了当代⽣物学中的关键研究领域。我们玻璃化的样本经过冷冻替代、在EPON树脂中包埋、超薄切⽚以及后续的透射电⼦显微镜观察一个完成的流程。
基于这⼀原理,我们对每种样本类型都进⾏了⾄少两次独⽴的HPF实验,并获得了有效的HPF曲线。总共,我们展⽰了来⾃25次独⽴实验的数据,涵盖了九种不同的样本类型(包括细胞沉淀物、组织和⼩型模式⽣物),这证明了我们的HPMLiveµ能够在200微⽶的物理深度限制内有效地对各种⽣物材料进⾏玻璃化处理。

样本结果图解
1. 单层细胞培养成细胞团
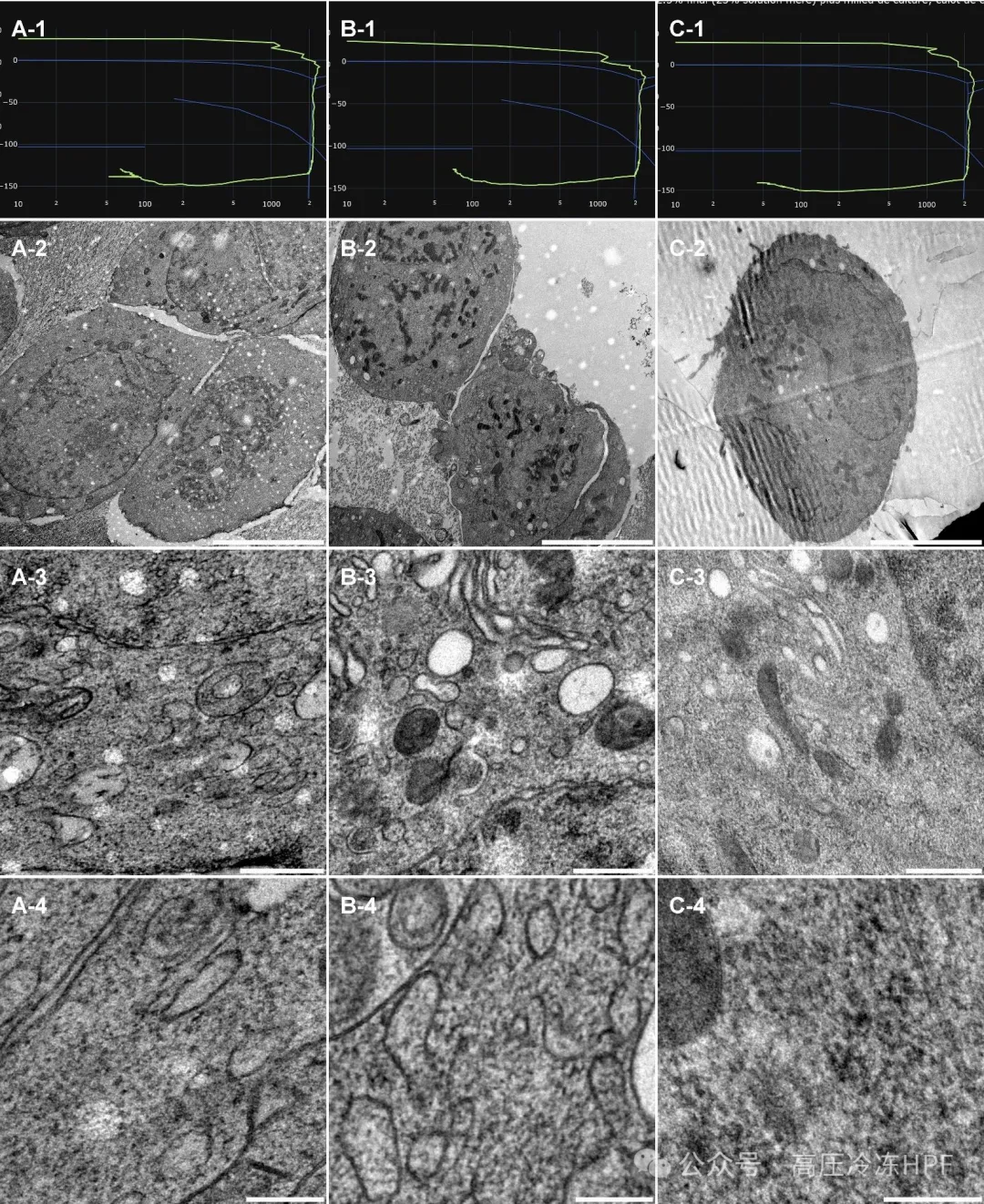
图解2 对 3 个人类细胞沉淀样本(A、B 和 C 列)进行形态学观察,这些样本经离心浓缩后重新悬浮于冷冻保护剂中。
第 1 行展示每个样本的高倍视野(HPF)曲线。
第 2 行展示样本概览,比例尺 5 μm。
第 3 行展示细胞器的总体保存情况和分布,比例尺 0.5 μm。
第 4 行展示更高倍数的详细视图,包括内体(A、B)、内质网(B)、线粒体(A、C)、细胞骨架(C)和细胞质(A、B、C),比例尺 0.2 μm。
2. 单层细胞培养在Cryocapsule中
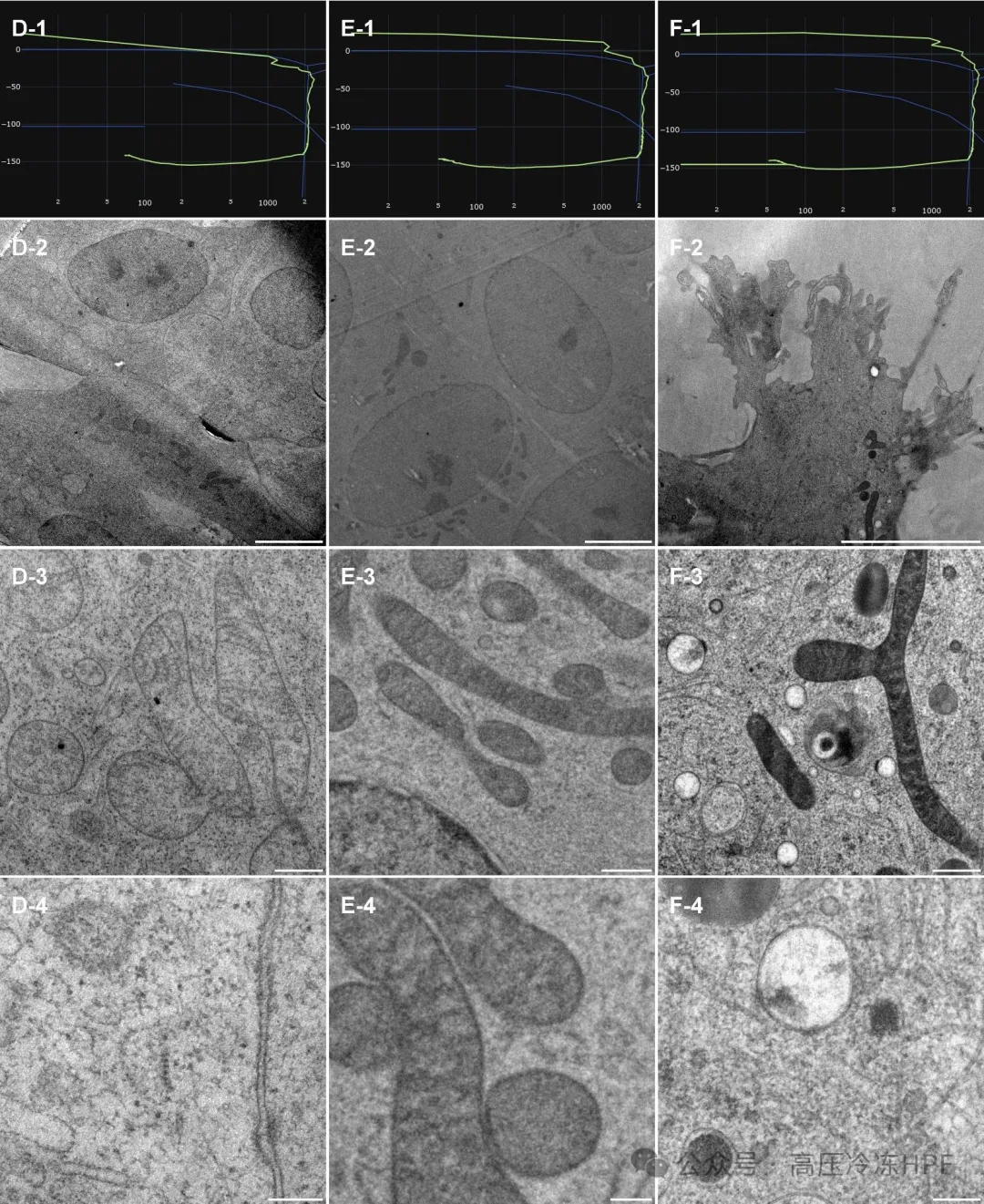
图解3:
第 1 行展示每个单独的高功率场发射扫描电镜(HPF)曲线。
第 2 行展示样本概览,比例尺 5 微米。
第 3 行展示细胞器的一般保存和分布情况,比例尺 0.5 微米。
第 4 行展示更高放大倍数的详细视图,比例尺 0.2 微米。
3.在CryoCapsule上培养的细胞单层的CLEM分析。

图解4:
第 0 行展示在高分辨率活细胞显微镜(HPM Live µ)下以 20 倍放大率观察到的每个感兴趣区域(ROI),比例尺为 20 μm。
第 1 行展示每个单独的高分辨率固定显微镜(HPF)曲线。
第 2 行展示样本概览,比例尺为 20 μm。
第 3 行展示一般细胞器的保存和分布情况,比例尺为 2 μm。
第 4 行展示微管、内体(G、H、I)、线粒体(H、I)、核孔复合体顶视图(H)和微管组织中心(I)的更高放大倍数图像,比例尺为 0.5 μm。
4.小鼠脑活检样本
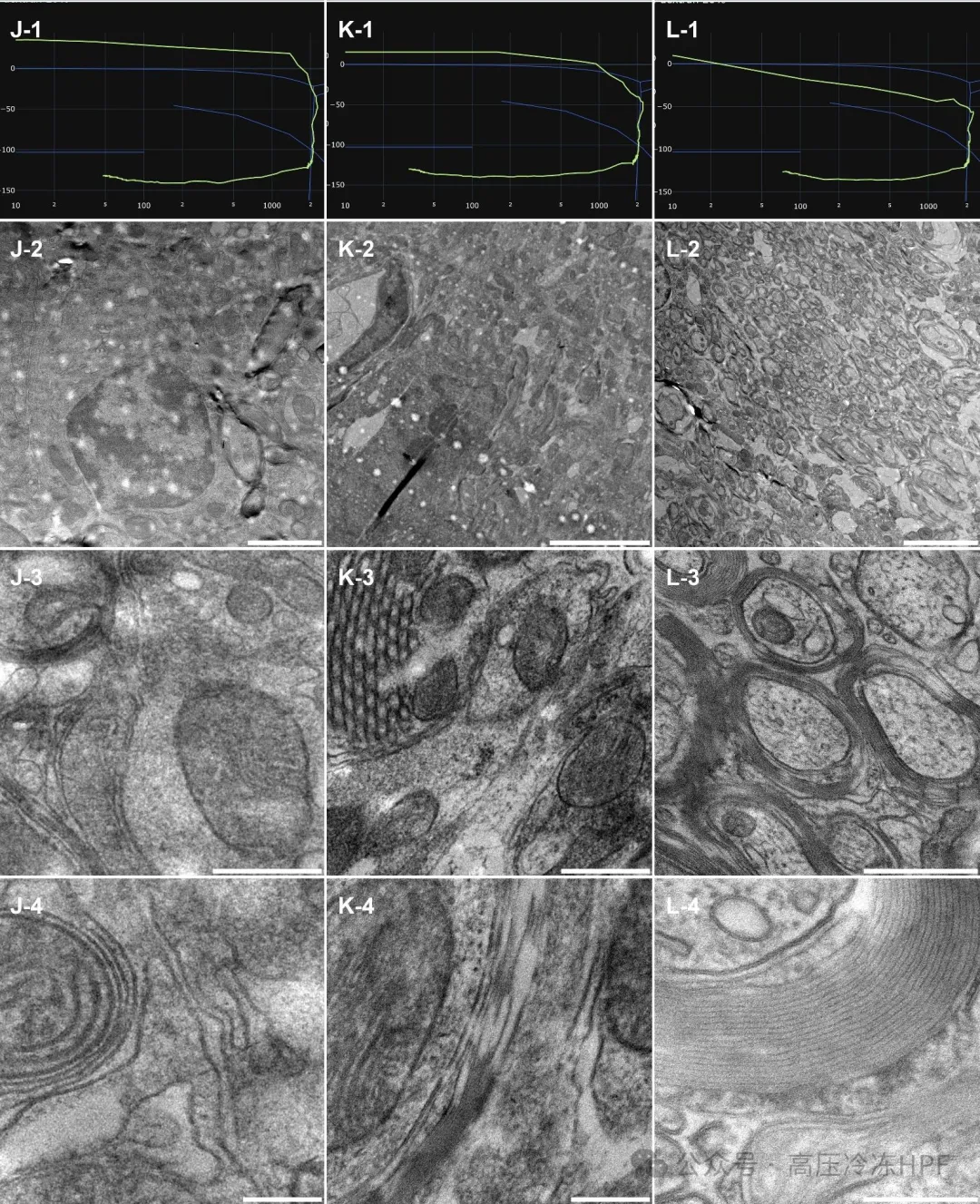
图解5:对 3 份小鼠脑活检样本(J、K 和 L 列)进行形态学观察,使用振荡刀切片机切片。
第 1 行展示每个高倍视野(HPF)的曲线。
第 2 行展示样本概览,比例尺 5 μm。
第 3 行展示细胞器的一般保存情况和分布,比例尺 0.5 μm。
第 4 行展示更高倍数的详细视图,包括膜、髓鞘、神经元囊泡和细
胞质,比例尺 0.2 μm。
5.小鼠肝脏活检组织
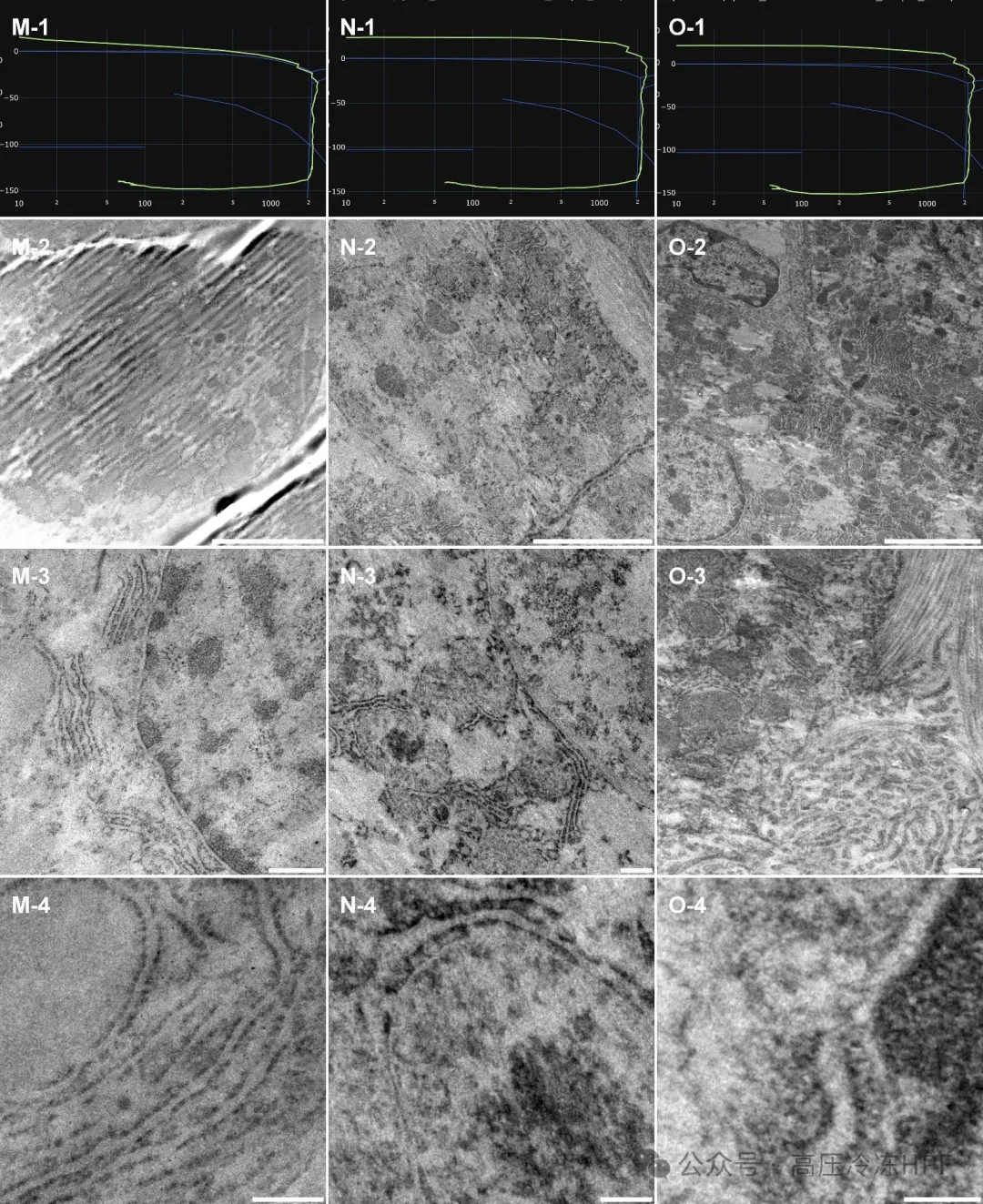
图解6:
第 1 行展示每个样本的高倍视野(HPF)曲线。
第 2 行展示样本概览,比例尺为 5 μm。
第 3 行展示保存完好的细胞器,比例尺为 0.5 μm。
第 4 行展示内质网(M)、糖原区室(N)和核膜(O)的膜结构的更高放大倍数细节图,比例尺为 0.2 μm。
6. 对秀丽隐杆线虫进行形态学观察。
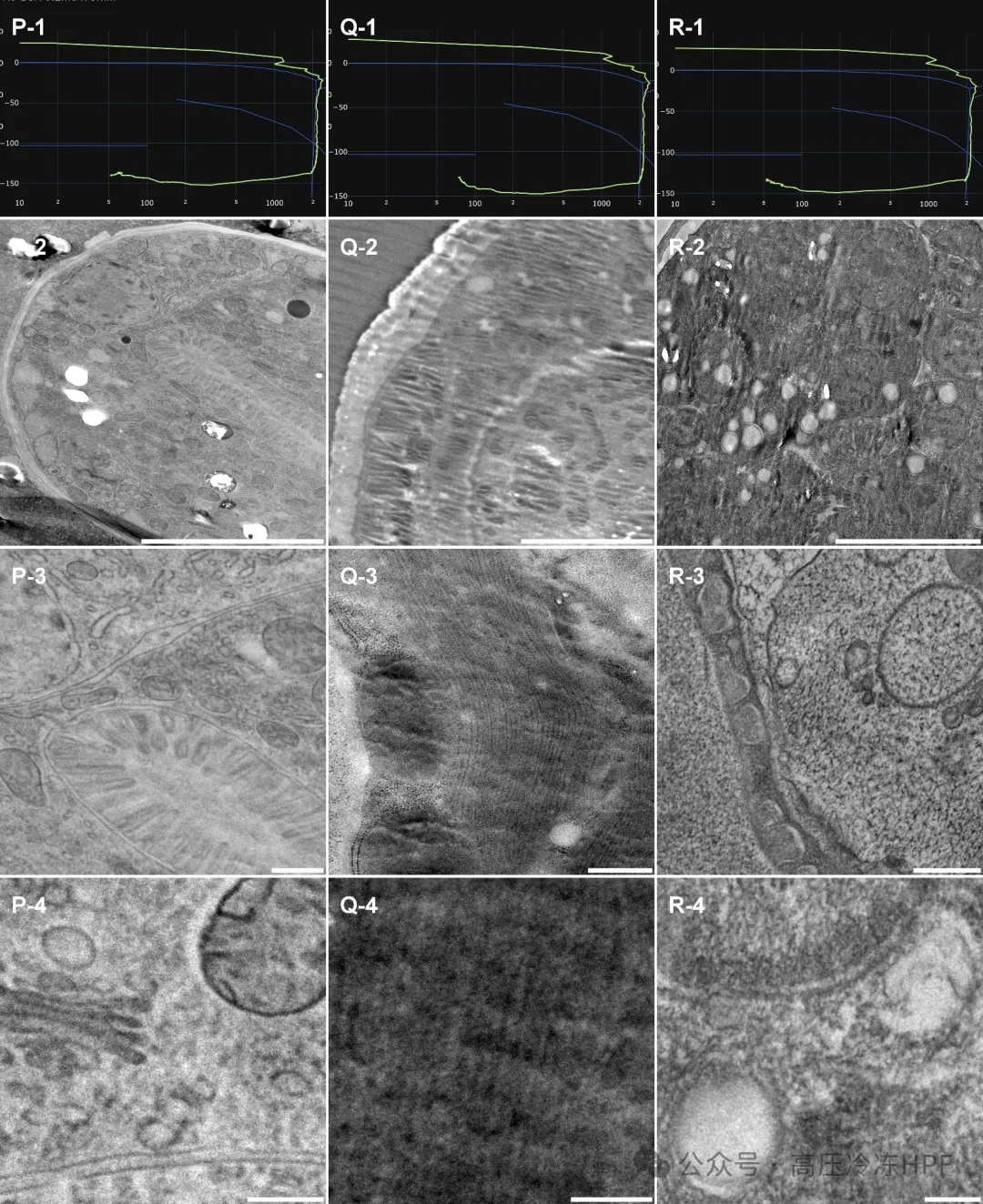
图解7:
第 1 行展示每个个体的 HPF 曲线。
第 2 行展示样本概览,比例尺 5 μm米。
第 3 行展示保存完好的细胞器,比例尺 0.5 μm。
第 4 行展示高尔基体、线粒体(P)、肌纤维(Q)、内体和核膜(R)膜的详细高倍放大图,比例尺 0.2 μm米。
7. 斑马鱼样本进行形态学观察。
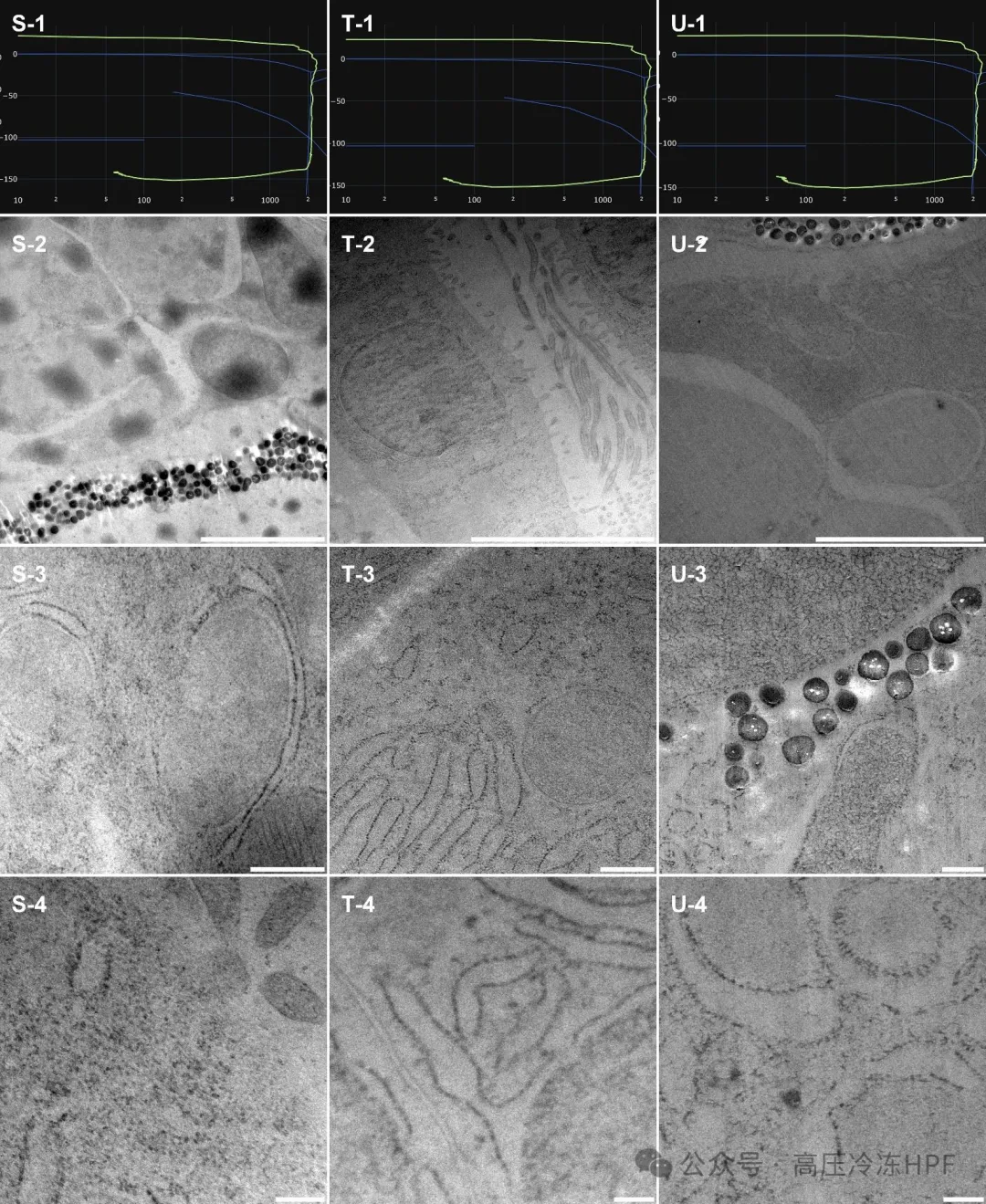
图解8:
第 1 行展示每个样本的 HPF 曲线。
第 2 行展示样本概览,比例尺 5 μm。
第 3 行展示保存完好的细胞器,比例尺 0.5 μm。
第 4 行展示内质网(S、T、U)和核膜(T)膜的详细高倍放大图,比例尺 0.2 μm。
8.对拟南芥根样本进行形态学观察。
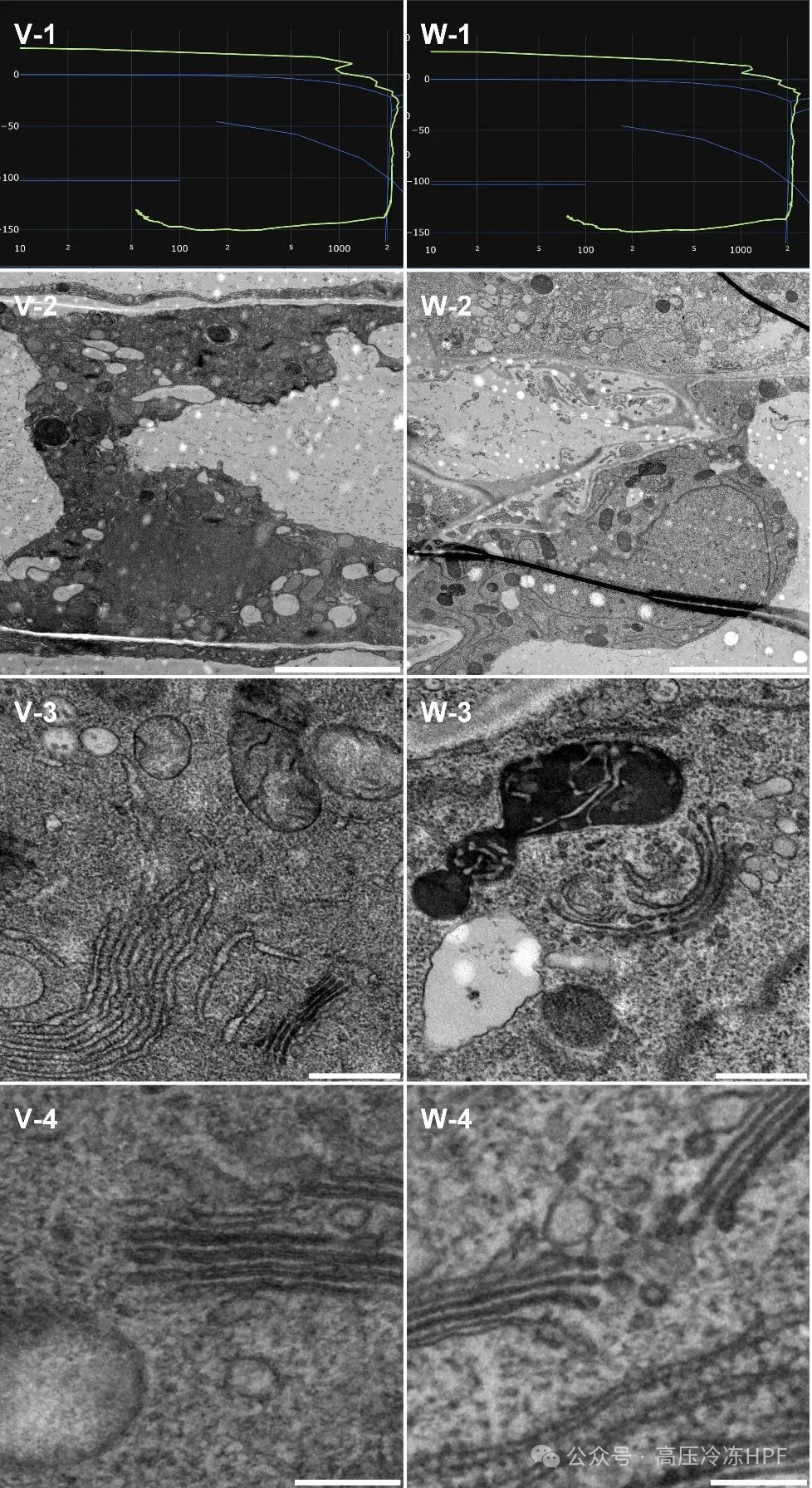
图解9:
第 1 行展示每个单独的 HPF 曲线。
第 2 行展示样本概览,比例尺 5 μm。
第 3 行展示保存完好的细胞器,比例尺 0.5 μm。
第 4 行展示高尔基体和内体(V、W)膜的详细高倍放大图,比例尺 0.2 μm。
9.对拟南芥幼苗样本进行形态学观察。
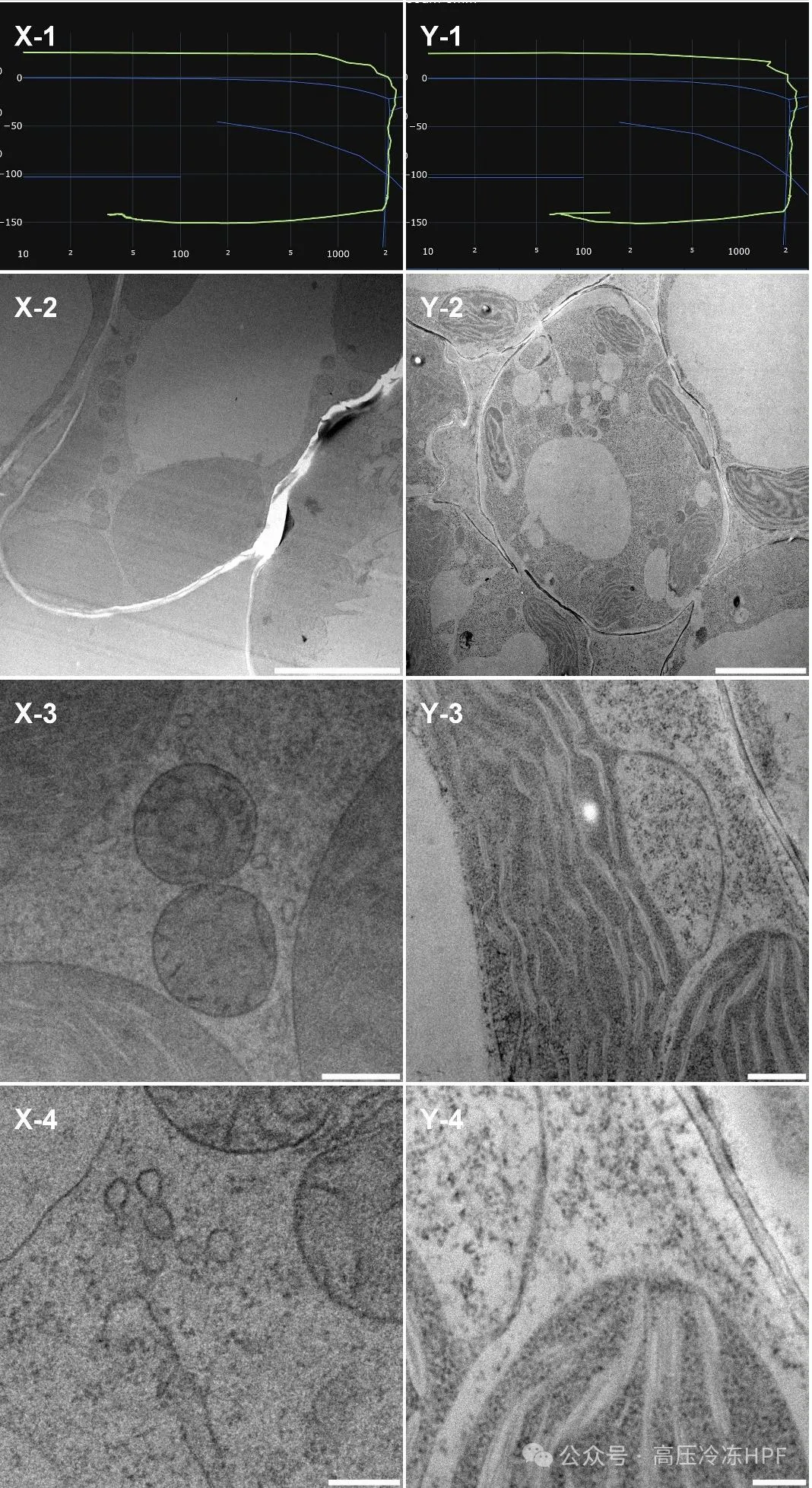
图解10:
第 1 行展示每个样本的 HPF 曲线。
第 2 行展示样本概览,比例尺 5 μm。
第 3 行展示保存完好的细胞器,比例尺 0.5 μm。
第 4 行展示线粒体、内体(X)、类囊体和细胞质(Y)的详细高倍放大图,比例尺 0.2 μm。

展望和优化
高压冷冻仪HPM Live µ的专利加压技术,能够在不到10毫秒的时间内迅速将压⼒升⾄2000bar。在通过⾼压冷冻实现样本玻璃化的过程中,如何区分这些解释是我们⾯临的下⼀个挑战。为了阐明潜在机制并深化对⾼压冷冻过程的理解,有必要进⾏进⼀步的研究和实验。
我们选择⽤于所有样本的EPON包埋树脂主要是基于其⼴泛的应⽤以及在包埋各种⽣物标本⽅⾯的⼀贯优质声誉。但需要注意的是,EPON树脂往往会降低冻代液中重⾦属盐所产⽣的对⽐度,通常需要进⾏后染⾊以增强可视化效果。在我们的研究中,我们特意避免了后染⾊,以尽量减少变异性,并展⽰每种样本制备⽅案的真实效果。
这种选择的⼀个明显后果体现在那些在冷冻替代过程中未接触四氧化锇的样本上,这些样本的对⽐度明显较弱,尤其是在膜结构⽅⾯,仅⽤醋酸铀⽆法充分弥补这⼀缺陷。四氧化锇虽然在增强对⽐度⽅⾯效果显著,但在健康⽅⾯却带来了重⼤挑战。
为克服这些挑战,我们建议考虑使⽤更透电⼦的树脂,如
HM20Lowicryl®(美国EMS公司),或者R221®(法国CryoCapCell公司)增强对⽐度的导电树脂,这些树脂能够在不损害样本完整性的情况下,提⾼细胞结构的可⻅度。
友情提示
https://doi.org/10.1101/2024.03.06.583669;

